EP0462506A1 - Pharmaceutical preparations of mixtures comprising cefotaxim and derivatives of xanthine and their use - Google Patents
Pharmaceutical preparations of mixtures comprising cefotaxim and derivatives of xanthine and their use Download PDFInfo
- Publication number
- EP0462506A1 EP0462506A1 EP91109673A EP91109673A EP0462506A1 EP 0462506 A1 EP0462506 A1 EP 0462506A1 EP 91109673 A EP91109673 A EP 91109673A EP 91109673 A EP91109673 A EP 91109673A EP 0462506 A1 EP0462506 A1 EP 0462506A1
- Authority
- EP
- European Patent Office
- Prior art keywords
- xanthine
- derivative
- methyl
- pharmaceutical combination
- cephalosporin
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/54—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame
- A61K31/542—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame ortho- or peri-condensed with heterocyclic ring systems
- A61K31/545—Compounds containing 5-thia-1-azabicyclo [4.2.0] octane ring systems, i.e. compounds containing a ring system of the formula:, e.g. cephalosporins, cefaclor, or cephalexine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Definitions
- the present invention relates to pharmaceutical combination preparations containing cephalosporin and xanthine derivatives and their use for the prophylaxis and treatment of bacterial infectious diseases and for the treatment and prophylaxis of septic shock.
- the antibiotic effect of cephalosporins has long been known.
- Different effects of xanthine derivatives are also known, including the TNF-inhibitory effect of xanthine derivatives (EP 0 344 586), which indicates the administration of xanthine derivatives in the case of septic shock.
- EP 0 344 586 the TNF-inhibitory effect of xanthine derivatives
- the invention accordingly relates to pharmaceutical combination preparations which contain at least one cephalosporin and at least one xanthine derivative.
- the combination preparations according to the invention are suitable for the prophylaxis and treatment of bacterial infectious diseases and in particular for the prophylaxis and treatment of septic shock.
- cephalosporin derivatives are described, for example, in German Offenlegungsschriften 27 02 501, 27 13 272, 27 15 385, 28 10 922, 29 21 316, 29 22 036, in EP 00 64 740, in GB 2 105 334 or GB 2 105 335.
- Physiologically acceptable salts of these compounds are also listed in the cited documents.
- R1 is C1-C4-alkyl, e.g. Methyl, ethyl or propyl, preferably methyl.
- R1 stands for carboxy-C1-C alkyl-alkyl, for example carboxymethyl, carboxyethyl or carboxypropyl, preferably the rest -CH2-COOH, but especially the rest of interest.
- R2 stands for a -CH2-pyridinium compound, the general formula I is the carboxyl group as an anion of an inner salt (-COO (-)).
- R3 can stand for hydrogen or a physiologically acceptable cation, such as an alkali, preferably potassium or sodium, in particular sodium, or other known from the literature, physiologically compatible cations such as, for example, alkaline earth metal or organic ammonium ions (see, for example, US Pat. No. 4,278,793).
- a physiologically acceptable cation such as an alkali, preferably potassium or sodium, in particular sodium, or other known from the literature, physiologically compatible cations such as, for example, alkaline earth metal or organic ammonium ions (see, for example, US Pat. No. 4,278,793).
- R3 can furthermore stand for a physiologically compatible ester residue which is particularly interesting for enteral application, such as e.g. for an acyloxymethyl or acyloxyethyl radical with 2 to 12, preferably 2 to 6, carbon atoms in the acyl part, preferably acetoxymethyl, 1 '(acetoxy) ethyl or pivaloyloxymethyl, for 5-methyl-1,3-dioxalen-2-one-4- yl-methyl, or also for other, physiologically compatible ester residues, as described for example in EP-A 0170028.
- a physiologically compatible ester residue which is particularly interesting for enteral application, such as e.g. for an acyloxymethyl or acyloxyethyl radical with 2 to 12, preferably 2 to 6, carbon atoms in the acyl part, preferably acetoxymethyl, 1 '(acetoxy) ethyl or pivaloyloxymethyl, for 5-methyl-1,3-dioxalen-2
- cephalosporin derivatives preferred according to the invention are selected from the group of the following compounds: Cefpirom, a compound of the formula Cefuroxime, a compound of the formula Ceftizoxime, a compound of the formula and ceftazidime, a compound of the formula
- cephalosporin derivatives are selected from the group of the following compounds: Cefepim, a compound of the formula 7 - [(2-Amino-thiazol-4-yl) methoxyimino-acetamido] -3- [4- (oxazol-5-yl) -1-pyrimidiniomethyl] -8-oxo-5-thia-1-azabicyclo [ 4.2.0] oct-2-en-2-carboxylate, a compound of the formula (6R, 7R) -7 - [(2-Amino-thiazol-4-yl) - ((Z) - (S) - ⁇ -carboxy-3,4-dihydroxy
- cephalosporin derivative is cefotaxim (Claforan®, Hoechst AG, Frankfurt).
- R5 represents a methyl or ethyl group.
- R4 or R6 represents the tertiary hydroxyalkyl group defined above.
- R7 is a methyl group and n is an integer from 3 to 5, so that the tertiary hydroxyalkyl radical IIIa is either [( ⁇ -1) -hydroxy- ( ⁇ -1) -methyl] -pentyl, -hexyl or -heptyl, especially those in which R5 is methyl or ethyl.
- a further embodiment of the invention is that the oxoalkylxanthines of the formulas I and II or the hydroxyalkylxanthines of the formulas I and III are not used per se, but in prodrug form, from which the therapeutically active xanthine compounds with those in the formulas are only present in the organism I, II and III defined substituents can be released by biotransformation.
- xanthine derivatives are e.g. in DE-B-1 233 405, DE-B-1 235 320 or DE 35 25 801 A1.
- cephalosporin derivatives can be administered both in combination with the xanthine derivatives in separate dosage units (simultaneously or in chronological order) as well as mixed with the xanthine derivatives.
- composition preparations according to the invention are produced by bringing at least one cephalosporin derivative and at least one xanthine derivative into a suitable administration form, optionally with further additives and / or auxiliary substances.
- the additives or auxiliaries come from the group of carriers, preservatives and other customary auxiliaries.
- auxiliaries such as starch, for example potato, corn or wheat starch, cellulose or their derivatives, in particular microcrystalline cellulose, silicon dioxide, various sugars such as milk sugar, magnesium carbonate and / or calcium phosphates can be used for oral dosage forms.
- auxiliaries to the oral dosage forms which improve the tolerability of the medicaments, such as, for example, slime formers and resins.
- the drugs can also be administered in the form of gastric insoluble capsules.
- Dosage form, or a component of the combination preparation to add a retardant, optionally in the form of permeable membranes, such as those based on cellulose or polystyrene resin, or ion exchangers.
- the pharmaceutical combination preparations mentioned can be applied in different ways. E.g. they can be administered intravenously, intramuscularly, intraperitoneally, subcutaneously or orally.
- the ratio of the cephalosporin derivatives to the xanthine derivatives can cover a wide range.
- a weight ratio of approximately 1: 100 to approximately 100: 1 is preferred, particularly preferably approximately 1:10 to approximately 10: 1.
- NMRI mice with a test weight of 10-22 g are used as test animals. During the experiments, the animals have access to tap water and grain feed ad libitum.
- CFU colony-forming units
- mice are infected intraperitoneally with 0.3 ml suspension of the three bacterial strains in 5% pig stomach mucin.
- the infection dose contains 10 to 500 times the lethal dose of bacteria.
- the infected animals in the untreated control group die within six to 24 hours after infection.
- a group of eight infected animals serves as infection control.
- the animals receive 0.5 ml physiological saline immediately after infection.
- a second group of eight infected animals is administered immediately after infection with 50 mg / kg HMHM i.p. treated.
- Another group (therapy control) of infected animals is administered with different doses of cefotaxime (contained in 0.5 ml water) and with physiological saline (0.5 ml) immediately after the infection i.p. treated.
- mice are i.p. Treated with different levels of cefotaxime (eight animals per cefotaxime concentration; cefotaxime dose as in group 3) and with 50 mg / kg HMHM.
- the number of surviving animals is noted daily over 10 days. Using these numbers, the mean effective dose (ED 50% ) of cefotaxime, ie the dose of cefotaxime that must be given to enable the survival of half of the test animals, is calculated using the probit method.
- the ED50 serves as a parameter for evaluating the chemotherapeutic activity of cefotaxime or the combinations of cefotaxime with HMHM.
Abstract
Description
Die vorliegende Erfindung betrifft pharmazeutische Kombinationspräparate enthaltend Cephalosporin- und Xanthinderivate und deren Verwendung zur Prophylaxe und Behandlung bakterieller Infektionskrankheiten und zur Behandlung und Prophylaxe des septischen Schocks.The present invention relates to pharmaceutical combination preparations containing cephalosporin and xanthine derivatives and their use for the prophylaxis and treatment of bacterial infectious diseases and for the treatment and prophylaxis of septic shock.
Die antibiobische Wirkung von Cephalosporinen ist seit langem bekannt. Ebenfalls bekannt sind unterschiedliche Wirkungen von Xanthin-Derivaten, u.a. auch die TNF-inhibitorische Wirkung von Xanthin-Derivaten (EP 0 344 586), die die Verabreichung von Xanthin-Derivaten im Falle des septischen Schocks angezeigt sein läßt. Überraschenderweise wurde nun gefunden, daß die Wirksamkeit von Cephalosporinderivaten durch die gleichzeitige Verabreichung von Xanthinderivaten signifikant gesteigert werden kann.
Erfindungsgegenstand sind demzufolge pharmazeutische Kombinationspräparate, die mindestens ein Cephalosporin- und mindestens ein Xanthinderivat enthalten.The antibiotic effect of cephalosporins has long been known. Different effects of xanthine derivatives are also known, including the TNF-inhibitory effect of xanthine derivatives (EP 0 344 586), which indicates the administration of xanthine derivatives in the case of septic shock. Surprisingly, it has now been found that the effectiveness of cephalosporin derivatives can be significantly increased by the simultaneous administration of xanthine derivatives.
The invention accordingly relates to pharmaceutical combination preparations which contain at least one cephalosporin and at least one xanthine derivative.
Die erfindungsgemäßen Kombinationspräparate eignen sich zur Prophylaxe und Behandlung von bakteriellen Infektionskrankheiten und insbesondere zur Prophylaxe und Behandlung des septischen Schocks.The combination preparations according to the invention are suitable for the prophylaxis and treatment of bacterial infectious diseases and in particular for the prophylaxis and treatment of septic shock.
Die Herstellung und die Eigenschaften von Cephalosporinderivaten sind z.B. beschrieben in den Deutschen Offenlegungsschriften 27 02 501, 27 13 272, 27 15 385, 28 10 922, 29 21 316, 29 22 036, in der EP 00 64 740, in der GB 2 105 334 oder der GB 2 105 335. Physiologisch verträgliche Salze dieser Verbindungen sind ebenfalls in den genannten Druckschriften aufgeführt.The preparation and properties of cephalosporin derivatives are described, for example, in German Offenlegungsschriften 27 02 501, 27 13 272, 27 15 385, 28 10 922, 29 21 316, 29 22 036, in EP 00 64 740, in GB 2 105 334 or GB 2 105 335. Physiologically acceptable salts of these compounds are also listed in the cited documents.
Bevorzugte Cephalosporinderivate sind diejenigen der Formel
in der A CH oder N bedeutet und
R₁ die Bedeutung besitzen kann von Wasserstoff, C₁-C₄-Alkyl, Carboxy-C₁-C₄-alkyl oder einer Gruppe der Formel
und in der die Gruppe =N-OR₁ in syn-Position steht, R₂ die Bedeutung haben kann von Wasserstoff, Methyl, Methoxy, Vinyl, Acetoxymethyl, Carbamoyloxymethyl, von
oder von
-CH₂S-X,
- mit Y =
- Wasserstoff, C₁-C₄-Alkylthio,
C₁-C₄-Alkoxy oder
C₃-C₅-Cycloalkyl,
oder von
wobei die ankondensierten Ringe auch in 3,4-Stellung stehen und auch durch Sauerstoff unterbrochen sein können, von
oder
von Thienopyridinio-methyl, Furopyridinio-methyl oder von 5-Methyl-tetrazol-2-yl-methyl und
R₃ für Wasserstoff, ein physiologisch verträgliches Kation, einen physiologisch verträglichen Esterrest oder - falls in R₂ die Struktur
auftritt - für eine negative Ladung stehen kann.
In der Formel I bedeutet A vorzugsweise CH.Preferred cephalosporin derivatives are those of the formula
in which A means CH or N and
R₁ can have the meaning of hydrogen, C₁-C₄-alkyl, carboxy-C₁-C₄-alkyl or a group of the formula
and in which the group = N-OR₁ is in the syn position, R₂ can have the meaning of hydrogen, methyl, methoxy, vinyl, acetoxymethyl, carbamoyloxymethyl, of
or from
-CH₂S-X,
- with Y =
- Hydrogen, C₁-C₄-alkylthio,
C₁-C₄ alkoxy or
C₃-C₅ cycloalkyl,
or from
wherein the condensed rings are also in the 3,4 position and can also be interrupted by oxygen, from
or
of thienopyridinio-methyl, furopyridinio-methyl or of 5-methyl-tetrazol-2-yl-methyl and
R₃ for hydrogen, a physiologically compatible cation, a physiologically compatible ester residue or - if in R₂ the structure
occurs - can represent a negative charge.
In formula I, A is preferably CH.
Steht R₁ für C₁-C₄-Alkyl, so kommen z.B. Methyl, Ethyl oder Propyl in Betracht, vorzugsweise Methyl.If R₁ is C₁-C₄-alkyl, e.g. Methyl, ethyl or propyl, preferably methyl.
Steht R₁ für Carboxy-C₁-C₄-alkyl, so sind z.B. Carboxymethyl, Carboxyethyl oder Carboxypropyl, vorzugsweise der Rest -CH₂-COOH, insbesondere jedoch der Rest
von Interesse.R₁ stands for carboxy-C₁-C alkyl-alkyl, for example carboxymethyl, carboxyethyl or carboxypropyl, preferably the rest -CH₂-COOH, but especially the rest
of interest.
Von den vorstehend aufgeführten substituierten Pyridiniummethyl-Resten sind bevorzugt 2,3-Cyclopenteno- und 2,5-Cyclohexeno-pyridinium-methyl, sowie 4-Methylthio-, 4-Cyclopropyl- und 3-Methoxy-pyridinium-methyl, sowie ebenfalls 3,4-Cyclopenteno- und 3,4-Cyclohexeno-pyridiniummethyl.Of the substituted pyridinium methyl radicals listed above, 2,3-cyclopenteno and 2,5-Cyclohexeno-pyridinium-methyl, as well as 4-methylthio-, 4-cyclopropyl- and 3-methoxy-pyridinium-methyl, as well as 3,4-cyclopenteno- and 3,4-cyclohexeno-pyridiniummethyl.
Erfindungsgemäß von ganz besonderem Interesse sind diejenigen Verbindungen der Formel I, in der R₁ für Methyl und R₂ für -CH₂-OCOCH₃ (Cefotaxim),
R₁ für -CH₂COOH und R₂ für -CH=CH₂ (Cefixim) steht, wobei innerhalb dieser Gruppe das Cefodizim, Cefpirom, Cefotaxim, Ceftriaxon nochmals eine Vorzugsstellung einnehmen.Of particular interest according to the invention are those compounds of the formula I in which R₁ is methyl and R₂ is -CH₂-OCOCH₃ (cefotaxime),
R₁ for -CH₂COOH and R₂ for -CH = CH₂ (cefixime), with cefodizime, cefpirom, cefotaxime and ceftriaxone again occupying a preferred position within this group.
Steht R₂ für eine -CH₂-Pyridinium-Verbindung, so liegt in der allgemeinen Formel I die Carboxylgruppe als Anion eines inneren Salzes (-COO(-)) vor.R₂ stands for a -CH₂-pyridinium compound, the general formula I is the carboxyl group as an anion of an inner salt (-COO (-)).
R₃ kann stehen für Wasserstoff oder ein physiologisch verträgliches Kation, wie z.B. ein Alkalikation, vorzugsweise Kalium oder Natrium, insbesondere Natrium, oder auch andere literaturbekannte, physiologisch verträgliche Kationen wie z.B. Erdalkali- oder organische Ammoniumionen (vgl. z.B. U.S. 4 278 793).R₃ can stand for hydrogen or a physiologically acceptable cation, such as an alkali, preferably potassium or sodium, in particular sodium, or other known from the literature, physiologically compatible cations such as, for example, alkaline earth metal or organic ammonium ions (see, for example, US Pat. No. 4,278,793).
R₃ kann weiterhin stehen für einen insbesondere für die enterale Applikation interessanten, physiologisch verträglichen Esterrest, wie z.B. für einen Acyloxymethyl- oder Acyloxyethylrest mit 2 bis 12, vorzugsweise 2 bis 6 C-Atomen im Acylteil, vorzugsweise Acetoxymethyl, 1'(Acetoxy)ethyl oder Pivaloyloxymethyl, für 5-Methyl-1,3-dioxalen-2-on-4-yl-methyl, oder auch für andere, physiologisch verträgliche Esterreste, wie sie beispielsweise in der EP-A 0170028 beschrieben sind.R₃ can furthermore stand for a physiologically compatible ester residue which is particularly interesting for enteral application, such as e.g. for an acyloxymethyl or acyloxyethyl radical with 2 to 12, preferably 2 to 6, carbon atoms in the acyl part, preferably acetoxymethyl, 1 '(acetoxy) ethyl or pivaloyloxymethyl, for 5-methyl-1,3-dioxalen-2-one-4- yl-methyl, or also for other, physiologically compatible ester residues, as described for example in EP-A 0170028.
Als besonders interessante Cephalosporinderivate seien ferner erwähnt unter den Aminothiazolcephalosporinen, die -CH₂- anstelle von -C(=N-OR₁)- enthalten, das Cefotiam und unter den N-Acyl-phenylglycin-cephalosporinen das Cefoperazon (vgl. z.B. EP-O 248 361).As particularly interesting cephalosporin derivatives are also mentioned among the aminothiazole cephalosporins, which contain -CH₂- instead of -C (= N-OR₁) -, the cefotiam and among the N-acyl-phenylglycine-cephalosporins, the cefoperazone (cf., for example, EP-O 248 361).
Weitere Beispiele für erfindungsgemäß bevorzugte Cephalosporinderivate sind ausgewählt aus der Gruppe der folgenden Verbindungen:
Cefpirom, eine Verbindung der Formel
Cefuroxim, eine Verbindung der Formel
Ceftizoxim, eine Verbindung der Formel
und Ceftazidim, eine Verbindung der Formel
Weitere besonders bevorzugte Cephalosporinderivate sind ausgewählt aus der Gruppe der folgenden Verbindungen:
Cefepim, eine Verbindung der Formel
7-[(2-Amino-thiazol-4-yl)-methoxyimino-acetamido]-3-[4-(oxazol-5-yl)-1-pyrimidiniomethyl]-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-en-2-carboxylat, eine Verbindung der Formel
(6R,7R)-7-[(2-Amino-thiazol-4-yl)-((Z)-(S)-α-carboxy-3,4-dihydroxy-benzyloxyimino)-acetamido]-3-[(2-carboxy-5-methyl-S-triazolo[1,5-a]-pyrimidin-7-yl)-thiomethyl]-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-en-2-carbonsäure,
eine Verbindung der Formel
(6R,7R)-7-[(5-Amino-1,2,4-thiadiazol-3-yl)-(Z)-methoxyimino-acetamido]-3-[4-carbamoyl-1-chinuclidiniomethyl]-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-en-2-carboxylat, eine Verbindung der Formel
sowie deren physiologisch verträgliche Salze oder Ester.Further examples of cephalosporin derivatives preferred according to the invention are selected from the group of the following compounds:
Cefpirom, a compound of the formula
Cefuroxime, a compound of the formula
Ceftizoxime, a compound of the formula
and ceftazidime, a compound of the formula
Further particularly preferred cephalosporin derivatives are selected from the group of the following compounds:
Cefepim, a compound of the formula
7 - [(2-Amino-thiazol-4-yl) methoxyimino-acetamido] -3- [4- (oxazol-5-yl) -1-pyrimidiniomethyl] -8-oxo-5-thia-1-azabicyclo [ 4.2.0] oct-2-en-2-carboxylate, a compound of the formula
(6R, 7R) -7 - [(2-Amino-thiazol-4-yl) - ((Z) - (S) -α-carboxy-3,4-dihydroxy-benzyloxyimino) -acetamido] -3 - [( 2-carboxy-5-methyl-S-triazolo [1,5-a] pyrimidin-7-yl) thiomethyl] -8-oxo-5-thia-1-azabicyclo [4.2.0] oct-2-ene -2-carboxylic acid,
a compound of the formula
(6R, 7R) -7 - [(5-amino-1,2,4-thiadiazol-3-yl) - (Z) -methoxyimino-acetamido] -3- [4-carbamoyl-1-quinuclidiniomethyl] -8- oxo-5-thia-1-azabicyclo [4.2.0] oct-2-en-2-carboxylate, a compound of the formula
and their physiologically tolerable salts or esters.
Ein ganz besonders bevorzugtes Cephalosporinderivat ist Cefotaxim (Claforan®, Hoechst AG, Frankfurt).A very particularly preferred cephalosporin derivative is cefotaxim (Claforan®, Hoechst AG, Frankfurt).
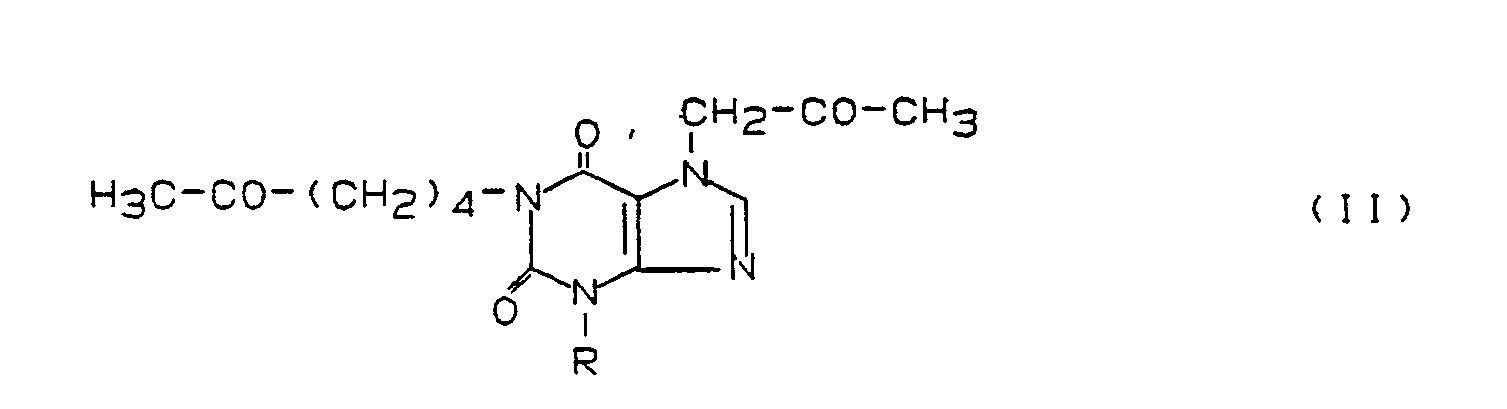
Bevorzugte erfindungsgemäß zu benutzende Xanthinderivate stammen aus der Gruppe der folgenden Verbindungen:
- 1) Verbindungen der Formel I
- 2) Verbindungen der Formel II
- 3) Verbindungen der Formel III
- 4) Prodrug-Formen der Verbindungen der Formeln I bis III und/oder
- 5) Metabolite der Verbindungen der Formeln I bis III. Unter diesen Verbindungen sind wiederum jene der Formel I besonders bevorzugt, die in der Position von R¹ oder R³ eine Hexyl-, 5-Oxohexyl- oder 5-Hydroxyhexylgruppe tragen. Zu ihnen gehören insbesondere 1-Hexyl-3,7-dimethylxanthin, 1-(5-Hydroxyhexyl)-3,7-dimethylxanthin, 3,7-(Dimethyl-1-(5-oxohexyl)-xanthin, 7-(5-Hydroxyhexyl)-1,3-dimethylxanthin, 1,3-Dimethyl-7-(5-oxohexyl)-xanthin, 1,3-Di-n-butyl-7-(2-oxopropyl)-xanthin, 1,3-Di-n-butyl-7-(3-oxobutyl)-xanthin, 1-(5-Hydroxyhexyl)-3-methyl-7-propylxanthin und 3-Methyl-1-(5-oxohexyl)-7-propylxanthin (= Propentofyllin), vor allem 3,7-Dimethyl-1-(5-oxohexyl)-xanthin (= Pentoxifyllin).
- 1) Compounds of formula I.
- 2) Compounds of formula II
- 3) Compounds of formula III
- 4) Prodrug forms of the compounds of the formulas I to III and / or
- 5) Metabolites of the compounds of the formulas I to III. Among these compounds, those of the formula I are again particularly preferred which carry a hexyl, 5-oxohexyl or 5-hydroxyhexyl group in the position of R 1 or R 3. They include, in particular, 1-hexyl-3,7-dimethylxanthine, 1- (5-hydroxyhexyl) -3,7-dimethylxanthine, 3,7- (dimethyl-1- (5-oxohexyl) xanthine, 7- (5- Hydroxyhexyl) -1,3-dimethylxanthine, 1,3-dimethyl-7- (5-oxohexyl) xanthine, 1,3-di-n-butyl-7- (2-oxopropyl) xanthine, 1,3-di -n-butyl-7- (3-oxobutyl) xanthine, 1- (5-hydroxyhexyl) -3-methyl-7-propylxanthine and 3-methyl-1- (5-oxohexyl) -7-propylxanthine (= propentofylline) , especially 3,7-dimethyl-1- (5-oxohexyl) xanthine (= pentoxifylline).
Weitere besonders bevorzugte Verbindungen der Formel III sind solche Verbindungen, bei denen R⁵ für eine Methyl- oder Ethylgruppe steht. Gleichermaßen bevorzugt sind jene Verbindungen der Formel III, in denen nur einer der beiden Reste R⁴ oder R⁶ die vorstehend definierte tertiäre Hydroxyalkylgruppe darstellt. Weiterhin bevorzugt sind solche Verbindungen, bei denen R⁷ für eine Methylgruppe steht und n eine ganze Zahl von 3 bis 5 bedeutet, so daß der tertiäre Hydroxyalkylrest IIIa entweder [(ω-1)-Hydroxy-(ω-1)-methyl]-pentyl, -hexyl oder -heptyl darstellt, insbesondere solche, bei denen R⁵ Methyl oder Ethyl bedeutet.Further particularly preferred compounds of the formula III are those compounds in which R⁵ represents a methyl or ethyl group. Equally preferred are those compounds of the formula III in which only one of the two radicals R⁴ or R⁶ represents the tertiary hydroxyalkyl group defined above. Are also preferred those compounds in which R⁷ is a methyl group and n is an integer from 3 to 5, so that the tertiary hydroxyalkyl radical IIIa is either [(ω-1) -hydroxy- (ω-1) -methyl] -pentyl, -hexyl or -heptyl, especially those in which R⁵ is methyl or ethyl.
Weiterhin sind diejenigen Verbindungen der Formel III besonders hervorzuheben, in denen R⁴ die tertiäre Hydroxyalkylgruppe darstellt und R⁶ für Wasserstoff, Alkyl, Hydroxyalkyl oder Alkoxyalkyl mit jeweils 1 bis 4 C-Atomen steht, wie etwa das 7-Propyl- oder 7-Ethoxymethyl-1-(5-hydroxy-5-methylhexyl)-3-methylxanthin und das 1-(5-Hydroxy-5-methylhexyl)-3-methylxanthin.
Ganz besonders bevorzugt ist 1-(5-Hydroxy-5-methylhexyl)-3-methylxanthin.In addition, those compounds of the formula III in which R⁴ is the tertiary hydroxyalkyl group and R⁶ is hydrogen, alkyl, hydroxyalkyl or alkoxyalkyl each having 1 to 4 carbon atoms, such as 7-propyl or 7-ethoxymethyl-1, are particularly noteworthy - (5-Hydroxy-5-methylhexyl) -3-methylxanthine and 1- (5-hydroxy-5-methylhexyl) -3-methylxanthine.
1- (5-Hydroxy-5-methylhexyl) -3-methylxanthine is very particularly preferred.
Eine weitere Ausführungsform der Erfindung besteht darin, daß die Oxoalkylxanthine der Formeln I und II bzw. die Hydroxyalkylxanthine der Formeln I und III nicht per se, sondern in Prodrug-Form eingesetzt werden, aus der erst im Organismus die therapeutische wirksamen Xanthinverbindungen mit den in Formeln I, II und III definierten Substituenten durch Biotransformation freigesetzt werden können. Hierfür kommen beispielsweise die acetalisierten Oxoalkylxanthine, in denen die Carbonylgruppen durch das Strukturelement der Formel IV
ersetzt sind, und die O-acylierten Hydroxyalkylxanthine mit dem Strukturelement der Formel (V)
R¹¹-CO-O- (V)
anstelle der Hydroxyfunktion in Frage, wobei R⁹ und R¹⁰ jeweils eine Alkylgruppe mit bis zu 4 C-Atomen oder zusammen eine Ethylen-, Trimethylen- oder Tetramethylengruppe darstellen und R¹¹ einen Alkylrest mit bis zu 4 C-Atomen oder gegebenenfalls substituiertes Phenyl oder Pyridyl bedeutet.A further embodiment of the invention is that the oxoalkylxanthines of the formulas I and II or the hydroxyalkylxanthines of the formulas I and III are not used per se, but in prodrug form, from which the therapeutically active xanthine compounds with those in the formulas are only present in the organism I, II and III defined substituents can be released by biotransformation. For this there are, for example, the acetalized oxoalkylxanthines in which the carbonyl groups are formed by the structural element of the formula IV
are replaced, and the O-acylated hydroxyalkylxanthines with the structural element of the formula (V)
R¹¹-CO-O- (V)
instead of the hydroxy function in question, where R⁹ and R¹⁰ each an alkyl group with up to 4 carbon atoms or together represent an ethylene, trimethylene or tetramethylene group and R¹¹ is an alkyl radical having up to 4 carbon atoms or optionally substituted phenyl or pyridyl.
Die Herstellung von Xanthinderivaten ist z.B. in der DE-B-1 233 405, der DE-B-1 235 320 oder der DE 35 25 801 A1 beschrieben.The preparation of xanthine derivatives is e.g. in DE-B-1 233 405, DE-B-1 235 320 or DE 35 25 801 A1.
Die Cephalosporinderivate können sowohl in Kombination mit den Xanthinderivaten in getrennten Dosierungseinheiten (gleichzeitig oder in zeitlicher Abfolge) als auch mit den Xanthinderivaten vermischt verabreicht werden.The cephalosporin derivatives can be administered both in combination with the xanthine derivatives in separate dosage units (simultaneously or in chronological order) as well as mixed with the xanthine derivatives.
Die Herstellung erfindungsgemäßer pharmazeutischer Kombinationspräparate, die ebenfalls zum Gegenstand der vorliegenden Erfindung gehört, erfolgt, indem mindestens ein Cephalosporinderivat und mindestens ein Xanthinderivat gegebenenfalls mit weiteren Zusatz- und/oder Hilfsstoffen in eine geeignete Darreichungsform gebracht werden. Die Zusatz- oder Hilfsstoffe stammen aus der Gruppe der Trägermittel, Konservierungsstoffe und anderer üblicher Hilfsstoffe. Z.B. können für orale Darreichungsformen Hilfsstoffe wie Stärke, z.B. Kartoffel-, Mais- oder Weizenstärke, Cellulose bzw. deren Derivate, insbesondere mikrokristalline Cellulose, Siliziumdioxid, verschiedene Zucker wie Milchzucker, Magnesiumcarbonat und/oder Calciumphosphate verwendet werden. Weiterhin ist es vorteilhaft, den oralen Darreichungsformen Hilfsstoffe zuzusetzen, die die Verträglichkeit der Medikamente verbessern, wie z.B. Schleimbildner und Harze. Zwecks besserer Verträglichkeit können die Medikamente auch in Form von magensaftunlöslichen Kapseln verabreicht werden. Darüber hinaus kann es vorteilhaft sein, der Darreichungsform, bzw. einer Komponente des Kombinationspräparats, ein Retardierungsmittel zuzusetzen, gegebenenfalls in Form von permeablen Membranen, wie z.B. solche auf Cellulose- oder Polystyrolharzbasis, oder Ionenaustauschern.Pharmaceutical combination preparations according to the invention, which also belongs to the subject of the present invention, are produced by bringing at least one cephalosporin derivative and at least one xanthine derivative into a suitable administration form, optionally with further additives and / or auxiliary substances. The additives or auxiliaries come from the group of carriers, preservatives and other customary auxiliaries. For example, auxiliaries such as starch, for example potato, corn or wheat starch, cellulose or their derivatives, in particular microcrystalline cellulose, silicon dioxide, various sugars such as milk sugar, magnesium carbonate and / or calcium phosphates can be used for oral dosage forms. It is also advantageous to add auxiliaries to the oral dosage forms which improve the tolerability of the medicaments, such as, for example, slime formers and resins. For better tolerability, the drugs can also be administered in the form of gastric insoluble capsules. In addition, it can be advantageous to Dosage form, or a component of the combination preparation, to add a retardant, optionally in the form of permeable membranes, such as those based on cellulose or polystyrene resin, or ion exchangers.
Die genannten pharmazeutischen Kombinationspräparate können auf unterschiedliche Weise appliziert werden. Z.B. können sie intravenös, intramuskulär, intraperitoneal, subkutan oder oral verabreicht werden.The pharmaceutical combination preparations mentioned can be applied in different ways. E.g. they can be administered intravenously, intramuscularly, intraperitoneally, subcutaneously or orally.
Bei den erfindungsgemäßen pharmazeutischen Kombinationspräparaten kann das Verhältnis der Cephalosporinderivate zu den Xanthinderivaten einen weiten Bereich überstreichen. Zu bevorzugen ist ein Gewichtsverhältnis von ca. 1:100 bis ca. 100:1, besonders bevorzugt von ca. 1:10 bis ca. 10:1.In the pharmaceutical combination preparations according to the invention, the ratio of the cephalosporin derivatives to the xanthine derivatives can cover a wide range. A weight ratio of approximately 1: 100 to approximately 100: 1 is preferred, particularly preferably approximately 1:10 to approximately 10: 1.
In dem nachfolgenden Beispiel wird die Steigerung der antibakteriellen Wirksamkeit von Cefotaxim durch die Kombination mit 1-(5-Hydroxy-5-methylhexyl)-methylxanthin (HMHM) untersucht.In the following example, the increase in the antibacterial activity of cefotaxime is investigated by the combination with 1- (5-hydroxy-5-methylhexyl) methylxanthine (HMHM).
Als Versuchstiere werden NMRI-Mäuse mit einem Versuchsgewicht von 10 - 22 g verwendet. Die Tiere haben während der Versuche Zugang zu Leitungswasser und Körnerfutter ad libitum.NMRI mice with a test weight of 10-22 g are used as test animals. During the experiments, the animals have access to tap water and grain feed ad libitum.
Die drei in dieser Studie verwendeten Bakterienstämme Staphylococcus aureus Giorgio, Escherichia coli 078 und Salmonella typhimurium MZ II zeigten in Vorversuchen bei Mäusen eine hohe Infektiosität. Suspensionen dieser Infektionserreger (in 15 % Magermilch als Gefrierschutz) werden in flüssigem Stickstoff aufbewahrt. Vor den Versuchen werden die Suspensionen in 5 %igem Mucin auf die mehrfach letalen Infektionsdosen (in Kolonie-bildenden Einheiten, KBE) eingestellt. Sie betragen 1 x 10⁶ KBE pro Maus bei der Infektion mit S. aureus Giorgio, 1 x 10⁴ KBE pro Maus bei der E. coli 078-Septikämie und 2,5 x 10³ KBE pro Maus bei der S. typhymurium MZ II-Infektion.The three bacterial strains Staphylococcus aureus Giorgio, Escherichia coli 078 and Salmonella typhimurium MZ II used in this study showed high infectivity in mice. Suspensions of these infectious agents (in 15% skim milk as freeze protection) are kept in liquid nitrogen. Before the experiments, the suspensions in 5% mucin are adjusted to the multiple lethal infection doses (in colony-forming units, CFU). They are 1 x 10⁶ CFU per mouse when infected with S. aureus Giorgio, 1 x 10⁴ CFU per mouse with E. coli 078 septicemia and 2.5 x 10³ CFU per mouse with S. typhymurium MZ II infection.
Die Mäuse werden intraperitoneal mit 0,3 ml Suspension der drei Bakterienstämme in 5 % Schweinemagen-Mucin infiziert.The mice are infected intraperitoneally with 0.3 ml suspension of the three bacterial strains in 5% pig stomach mucin.
Die Infektionsdosis enthält, je nach Keim, die 10 bis 500-fache letale Dosis an Bakterien. Je nach Infektionserreger sterben die infizierten Tiere der unbehandelten Kontrollgruppe innerhalb von sechs bis 24 Stunden nach Setzen der Infektion.Depending on the germ, the infection dose contains 10 to 500 times the lethal dose of bacteria. Depending on the infectious agent, the infected animals in the untreated control group die within six to 24 hours after infection.
Eine Gruppe von acht infizierten Tieren dient als Infektionskontrolle. Die Tiere erhalten 0,5 ml physiologische Kochsalzlösung unmittelbar nach Setzen der Infektion.A group of eight infected animals serves as infection control. The animals receive 0.5 ml physiological saline immediately after infection.
Eine zweite Gruppe von acht infizierten Tieren wird unmittelbar nach der Infektion mit 50 mg/kg HMHM i.p. behandelt. Eine weitere Gruppe (Therapiekontrolle) von infizierten Tieren wird mit verschieden hohen Dosen von Cefotaxim (enthalten in 0,5 ml Wasser) und mit physiologischer Kochsalzlösung (0,5 ml) unmittelbar nach der Infektion i.p. behandelt.A second group of eight infected animals is administered immediately after infection with 50 mg / kg HMHM i.p. treated. Another group (therapy control) of infected animals is administered with different doses of cefotaxime (contained in 0.5 ml water) and with physiological saline (0.5 ml) immediately after the infection i.p. treated.
Eine vierte Gruppe von Mäusen wird unmittelbar nach der Infektion i.p. mit verschieden hohen Cefotaxim-Konzentrationen (acht Tiere pro Cefotaxim-Konzentration; Cefotaxim-Dosis wie in Gruppe 3) und mit 50 mg/kg HMHM therapiert.A fourth group of mice are i.p. Treated with different levels of cefotaxime (eight animals per cefotaxime concentration; cefotaxime dose as in group 3) and with 50 mg / kg HMHM.
Die Zahl der überlebenden Tiere wird über 10 Tage täglich notiert. Anhand dieser Zahlen wird mit Hilfen der Probit-Methode die mittlere effektive Dosis (ED50%) von Cefotaxim berechnet, d.h. diejenige Cefotaxim-Dosis, die gegeben werden muß, um das Überleben der Hälfte der Versuchstiere zu ermöglichen.The number of surviving animals is noted daily over 10 days. Using these numbers, the mean effective dose (ED 50% ) of cefotaxime, ie the dose of cefotaxime that must be given to enable the survival of half of the test animals, is calculated using the probit method.
Die ED₅₀ dient als Parameter zur Bewertung der chemotherapeutischen Aktivität von Cefotaxim bzw. der Kombinationen von Cefotaxim mit HMHM.
Claims (10)
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE4019571A DE4019571A1 (en) | 1990-06-20 | 1990-06-20 | PHARMACEUTICAL COMBINATION PRODUCTS CONTAINING CEPHALOSPORINE AND XANTHINE DERIVATIVES AND THEIR USE |
| DE4019571 | 1990-06-20 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| EP0462506A1 true EP0462506A1 (en) | 1991-12-27 |
| EP0462506B1 EP0462506B1 (en) | 1996-11-06 |
Family
ID=6408686
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP91109673A Expired - Lifetime EP0462506B1 (en) | 1990-06-20 | 1991-06-13 | Pharmaceutical preparations of mixtures comprising cefotaxim and derivatives of xanthine and their use |
Country Status (26)
| Country | Link |
|---|---|
| US (1) | US5350753A (en) |
| EP (1) | EP0462506B1 (en) |
| JP (1) | JP3213339B2 (en) |
| KR (1) | KR100205161B1 (en) |
| CN (1) | CN1057390A (en) |
| AT (1) | ATE144901T1 (en) |
| AU (1) | AU643291B2 (en) |
| BR (1) | BR9102554A (en) |
| CA (1) | CA2044977A1 (en) |
| CZ (1) | CZ282285B6 (en) |
| DE (2) | DE4019571A1 (en) |
| DK (1) | DK0462506T3 (en) |
| ES (1) | ES2093656T3 (en) |
| FI (1) | FI912968A (en) |
| GR (1) | GR3021568T3 (en) |
| HR (1) | HRP940708B1 (en) |
| HU (1) | HU212937B (en) |
| IE (1) | IE76290B1 (en) |
| IL (1) | IL98535A (en) |
| MX (1) | MX26309A (en) |
| NO (1) | NO912382L (en) |
| NZ (1) | NZ238580A (en) |
| PT (1) | PT98028B (en) |
| RU (1) | RU2095063C1 (en) |
| YU (1) | YU48415B (en) |
| ZA (1) | ZA914709B (en) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1995013075A1 (en) * | 1993-11-12 | 1995-05-18 | Cell Therapeutics, Inc. | Method for preventing tissue injury from hypoxia |
| EP0812844A2 (en) * | 1996-06-07 | 1997-12-17 | Hoechst Aktiengesellschaft | Use of theophyllin derivatives for the treatment and prophylaxis fo shock conditions, novel xanthine compounds and processes for the production thereof |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MXPA05005398A (en) * | 2002-11-22 | 2006-03-09 | Univ Johns Hopkins | Target for therapy of cognitive impairment. |
| KR101315483B1 (en) * | 2011-06-23 | 2013-10-07 | 주식회사 아리바이오 | A composition comprising antibiotics and lysophosphatidylcholine for enhancing immune or treating bacterial infection |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0344586A2 (en) * | 1988-05-27 | 1989-12-06 | Taiho Pharmaceutical Co., Ltd. | Medicine containing a TNF inhibitor |
-
1990
- 1990-06-20 DE DE4019571A patent/DE4019571A1/en not_active Withdrawn
-
1991
- 1991-06-13 DK DK91109673.3T patent/DK0462506T3/en active
- 1991-06-13 EP EP91109673A patent/EP0462506B1/en not_active Expired - Lifetime
- 1991-06-13 DE DE59108321T patent/DE59108321D1/en not_active Expired - Fee Related
- 1991-06-13 AT AT91109673T patent/ATE144901T1/en not_active IP Right Cessation
- 1991-06-13 ES ES91109673T patent/ES2093656T3/en not_active Expired - Lifetime
- 1991-06-17 IL IL9853591A patent/IL98535A/en not_active IP Right Cessation
- 1991-06-18 FI FI912968A patent/FI912968A/en not_active Application Discontinuation
- 1991-06-18 NZ NZ238580A patent/NZ238580A/en unknown
- 1991-06-18 US US07/717,330 patent/US5350753A/en not_active Expired - Lifetime
- 1991-06-19 ZA ZA914709A patent/ZA914709B/en unknown
- 1991-06-19 YU YU108291A patent/YU48415B/en unknown
- 1991-06-19 CN CN91104066A patent/CN1057390A/en active Pending
- 1991-06-19 MX MX2630991A patent/MX26309A/en unknown
- 1991-06-19 IE IE210791A patent/IE76290B1/en not_active IP Right Cessation
- 1991-06-19 KR KR1019910010126A patent/KR100205161B1/en not_active IP Right Cessation
- 1991-06-19 CA CA002044977A patent/CA2044977A1/en not_active Abandoned
- 1991-06-19 HU HU912048A patent/HU212937B/en not_active IP Right Cessation
- 1991-06-19 CZ CS911878A patent/CZ282285B6/en unknown
- 1991-06-19 PT PT98028A patent/PT98028B/en not_active IP Right Cessation
- 1991-06-19 BR BR919102554A patent/BR9102554A/en not_active Application Discontinuation
- 1991-06-19 AU AU78482/91A patent/AU643291B2/en not_active Ceased
- 1991-06-19 RU SU914895659A patent/RU2095063C1/en active
- 1991-06-19 NO NO91912382A patent/NO912382L/en unknown
- 1991-06-20 JP JP14870591A patent/JP3213339B2/en not_active Expired - Fee Related
-
1994
- 1994-10-19 HR HRP-1082/91A patent/HRP940708B1/en not_active IP Right Cessation
-
1996
- 1996-11-07 GR GR960402852T patent/GR3021568T3/en unknown
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0344586A2 (en) * | 1988-05-27 | 1989-12-06 | Taiho Pharmaceutical Co., Ltd. | Medicine containing a TNF inhibitor |
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1995013075A1 (en) * | 1993-11-12 | 1995-05-18 | Cell Therapeutics, Inc. | Method for preventing tissue injury from hypoxia |
| US5856331A (en) * | 1993-11-12 | 1999-01-05 | Cell Therapeutics, Inc. | Method for preventing tissue injury from hypoxia |
| US6638938B1 (en) | 1993-11-12 | 2003-10-28 | Cell Therapeutics, Inc. | Method for preventing tissue injury from hypoxia |
| EP0812844A2 (en) * | 1996-06-07 | 1997-12-17 | Hoechst Aktiengesellschaft | Use of theophyllin derivatives for the treatment and prophylaxis fo shock conditions, novel xanthine compounds and processes for the production thereof |
| EP0812844A3 (en) * | 1996-06-07 | 1998-04-08 | Hoechst Aktiengesellschaft | Use of theophyllin derivatives for the treatment and prophylaxis fo shock conditions, novel xanthine compounds and processes for the production thereof |
| AU712277B2 (en) * | 1996-06-07 | 1999-11-04 | Hoechst Aktiengesellschaft | Use of theophylline derivatives for the treatment and prophylaxis of states of shock, novel xanthine compounds and processes for their preparation |
| US6214992B1 (en) | 1996-06-07 | 2001-04-10 | Hoechst Aktiengesellschaft | Use of theophylline derivatives for the treatment and prophylaxis of states of shock, novel xanthine compounds and processes for their preparation |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE3137854C2 (en) | ||
| EP0344586B1 (en) | Medicine containing a TNF inhibitor | |
| GB1221855A (en) | Penicillin and cephalosporin derivatives | |
| DE3019244C2 (en) | ||
| DE3233377A1 (en) | CEPHALOSPORINISOCHINOLINIUM BETAINE AND PHARMACEUTICAL PRODUCTS CONTAINING THEM | |
| US4467086A (en) | Cephalosporin antibiotic | |
| AU647307B2 (en) | Diastereomers of 1-(isopropoxycarbonyloxy)ethyl 3-cephem-4-carboxylate and processes for their preparation | |
| EP0462506A1 (en) | Pharmaceutical preparations of mixtures comprising cefotaxim and derivatives of xanthine and their use | |
| DE2234280B2 (en) | Cephalosporin compounds and processes for their preparation | |
| DD204257A5 (en) | PROCESS FOR THE PREPARATION OF CEPHALOSPORINES SUBSTITUTED IN POSITION 3 | |
| CH631458A5 (en) | METHOD FOR PRODUCING NEW PENICILLIN DERIVATIVES. | |
| CH634326A5 (en) | 2-HYDROXYIMINOACETAMIDO-CEPHEMCARBONIC ACIDS AND THEIR PRODUCTION. | |
| DE2927683A1 (en) | NEW CEPHALOSPORINE DERIVATIVES, METHOD FOR THEIR PRODUCTION AND MEDICINAL PRODUCTS | |
| AT359195B (en) | METHOD FOR PRODUCING NEW CEPHALOS PORINE COMPOUNDS AND THEIR PHARMACEUTICAL APPLICABLE SALTS | |
| DE4142423A1 (en) | ((LS) -HYDROXYALKYL) OXAPENEM-3-CARBON ACIDS AND THEIR USE AS BETALACTAMATE HEMMER | |
| DE2645144A1 (en) | CEPHALOSPORINE COMPOUNDS, PROCESS FOR THEIR PRODUCTION AND PHARMACEUTICAL PRODUCTS CONTAINING THEM | |
| DE2760482C2 (en) | Thiazolyl methoxy-imino-acetamido cephalosporins | |
| EP0388510A1 (en) | Pharmaceutical compositions and their use in the prophylaxis or the treatment of bacterial infectious diseases | |
| DE1670788B2 (en) | 3-Dithiocarbamate derivatives of cephalosporins!) And process for their preparation | |
| DE2263439A1 (en) | AGAINST METHICILLIN RESISTANT STRAINS OF STAPHYLOCOCCUS AUREUS EFFECTIVE ANTIBIOTICA | |
| LU83588A1 (en) | CEPHALOSPORINE DERIVATIVES | |
| DD201683A5 (en) | METHOD FOR THE PRODUCTION OF ESTERS OF CEPHALOSPORIN DERIVATIVES |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| AK | Designated contracting states |
Kind code of ref document: A1 Designated state(s): AT BE CH DE DK ES FR GB GR IT LI LU NL SE |
|
| 17P | Request for examination filed |
Effective date: 19920428 |
|
| 17Q | First examination report despatched |
Effective date: 19931208 |
|
| RAP1 | Party data changed (applicant data changed or rights of an application transferred) |
Owner name: SCHRINNER, ELMAR J., DR. |
|
| GRAH | Despatch of communication of intention to grant a patent |
Free format text: ORIGINAL CODE: EPIDOS IGRA |
|
| RAP1 | Party data changed (applicant data changed or rights of an application transferred) |
Owner name: TAIHO PHARMACEUTICAL CO., LTD. |
|
| GRAH | Despatch of communication of intention to grant a patent |
Free format text: ORIGINAL CODE: EPIDOS IGRA |
|
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| AK | Designated contracting states |
Kind code of ref document: B1 Designated state(s): AT BE CH DE DK ES FR GB GR IT LI LU NL SE |
|
| REF | Corresponds to: |
Ref document number: 144901 Country of ref document: AT Date of ref document: 19961115 Kind code of ref document: T |
|
| ITF | It: translation for a ep patent filed |
Owner name: ING. A. GIAMBROCONO & C. S.R.L. |
|
| REG | Reference to a national code |
Ref country code: DK Ref legal event code: T3 |
|
| REF | Corresponds to: |
Ref document number: 59108321 Country of ref document: DE Date of ref document: 19961212 |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: NV Representative=s name: BOVARD AG PATENTANWAELTE |
|
| GBT | Gb: translation of ep patent filed (gb section 77(6)(a)/1977) |
Effective date: 19961125 |
|
| REG | Reference to a national code |
Ref country code: ES Ref legal event code: FG2A Ref document number: 2093656 Country of ref document: ES Kind code of ref document: T3 |
|
| REG | Reference to a national code |
Ref country code: GR Ref legal event code: FG4A Free format text: 3021568 |
|
| ET | Fr: translation filed | ||
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: AT Payment date: 19970530 Year of fee payment: 7 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: DK Payment date: 19970612 Year of fee payment: 7 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: LU Payment date: 19970616 Year of fee payment: 7 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: SE Payment date: 19970618 Year of fee payment: 7 Ref country code: CH Payment date: 19970618 Year of fee payment: 7 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: ES Payment date: 19970624 Year of fee payment: 7 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: GR Payment date: 19970626 Year of fee payment: 7 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: BE Payment date: 19970805 Year of fee payment: 7 |
|
| PLBE | No opposition filed within time limit |
Free format text: ORIGINAL CODE: 0009261 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: NO OPPOSITION FILED WITHIN TIME LIMIT |
|
| 26N | No opposition filed | ||
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: LU Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19980613 Ref country code: AT Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19980613 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: SE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19980614 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: ES Free format text: LAPSE BECAUSE OF EXPIRATION OF PROTECTION Effective date: 19980615 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: LI Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19980630 Ref country code: GR Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19980630 Ref country code: DK Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19980630 Ref country code: CH Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19980630 Ref country code: BE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19980630 |
|
| BERE | Be: lapsed |
Owner name: TAIHO PHARMACEUTICAL CO. LTD Effective date: 19980630 |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: PL |
|
| EUG | Se: european patent has lapsed |
Ref document number: 91109673.3 |
|
| REG | Reference to a national code |
Ref country code: DK Ref legal event code: EBP |
|
| REG | Reference to a national code |
Ref country code: ES Ref legal event code: FD2A Effective date: 20000601 |
|
| REG | Reference to a national code |
Ref country code: GB Ref legal event code: IF02 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: FR Payment date: 20030610 Year of fee payment: 13 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: GB Payment date: 20030611 Year of fee payment: 13 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: DE Payment date: 20030626 Year of fee payment: 13 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: NL Payment date: 20030630 Year of fee payment: 13 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: GB Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20040613 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: NL Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20050101 Ref country code: DE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20050101 |
|
| GBPC | Gb: european patent ceased through non-payment of renewal fee |
Effective date: 20040613 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: FR Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20050228 |
|
| NLV4 | Nl: lapsed or anulled due to non-payment of the annual fee |
Effective date: 20050101 |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: ST |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: IT Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES;WARNING: LAPSES OF ITALIAN PATENTS WITH EFFECTIVE DATE BEFORE 2007 MAY HAVE OCCURRED AT ANY TIME BEFORE 2007. THE CORRECT EFFECTIVE DATE MAY BE DIFFERENT FROM THE ONE RECORDED. Effective date: 20050613 |